La caracterización citogenética en bovinos fue objeto de estudio desde el siglo pasado. Los primeros trabajos se realizaron sobre material testicular de toro (espermatogénesis). La primera comunicación se efectuó en el año 1892 por Von Bardeleben, donde encuentra un número cromosómico de 2n=16. En 1902, Schoenfeld propone un 2n entre 20 y 25 y en 1913, Van Hoof encuentra un 2n entre 20 y 24. En 1919, Masui propone un número cromosómico de 2n=33, y una relación XO para la determinación cromosómica del sexo (Eldridge, 1985). Wodsedalek en el año 1920 realiza estudios en testículo y ovario encontrando 37 cromosomas en espermatogonias y 38 cromosomas en oogonias, concluyendo que los machos presentaban una relación cromosómica sexual XO mientras que las hembras se presentaban como XX. Durante los años 1927 y 1931, Krallinger describe por primera vez el número diploide que hoy caracteriza a esta especie (Hembras (F) 2n=60, XX, Machos (M) 2n=60, XY). Entre los años 1943 al 1944, Makino, verifica el número diploide 2n=60, indicando que no existen diferencias en el número y mecanismo cromosómico de determinación sexual entre especies del mismo género como lo son Bos taurus taurus y Bos taurus indicus.
Hasta el año 1952 el material era procesado por los métodos clásicos de fijación, inclusión en bloques de parafina y tinción con anilinas. A partir de este año, Makino y Nishimura proponen una nueva técnica que sustituye a la clásica por ser más rápida, simple y eficiente. Esta consiste en tratamientos del material con baños de agua, y varias etapas de fijación con distintas soluciones de ácido acético, para una posterior tinción con fucsina y aplastado del material.
A partir de la década del 60 con el mejoramiento de las técnicas de cultivo linfocitario para obtención de cromosomas metafásicos humanos diversos autores comienzan a introducir modificaciones para adecuar estos métodos al cultivo de células de bovinos (Halnan, 1989). El esclarecimiento completo de la morfología cromosómica del Bos taurus se consolida cuando se utiliza como material de estudio los siguientes tipos celulares: médula ósea, fibroblastos y linfocitos quedando establecido el número y morfología cromosómica en 2n=60. Este está constituido por 29 pares de cromosomas acrocéntricos y un par sexual de morfología submetacéntrica, con un X de gran tamaño y un Y de pequeño tamaño. Jorge (1974), realiza estudios citogenéticos comparativos entre razas pertenecientes a Bos taurus taurus y Bos taurus indicus, encontrando una morfología acrocéntrica del cromosoma Y en esta última subespecie.
El advenimiento de las técnicas de bandeamiento cromosómico, permitió una mejor identificación de los pares de homólogos, realizando así un análisis más profundo de su estructura y del cariotipo. El primer paso en bandeo cromosómico bovino fue dado por Hansen (1972) con el empleo de un fluorocromo, la mostaza de quinacrina (bandas Q). Casi simultáneamente se introducen las técnicas de bandeo C (Hansen, 1973; Popescu, 1973, 1975) y de bandeo G (Schnedl y Czaker, 1974). En el año 1976 se realiza la primer Conferencia Internacional para la estandarización de los bandeos cromosómicos en animales domésticos. En la misma se logra la estandarización para las bandas G del Bos taurus taurus, llamando la atención la gran banda clara (G -) central encontrada en el brazo largo (q) del cromosoma sexual X. Esta banda divide a dicho brazo en dos partes, encontrándose en cada una de éstas, dos o más bandas oscuras (G+) (Ford et al. 1980; Gustavsson, 1980).
En el año 1982, Di Berardino y Ianuzzi, realizan la descripción detallada del bandeo R en Bos taurus utilizando la incorporación tardía a los cultivos linfocitarios de 5'bromodeoxiuridina (BrdU), con posterior tinción con naranja de acridina, técnica conocida como bandeo RBA. Mediante este bandeo se estableció que el brazo q del cromosoma sexual X presentaba una prominente banda negativa de localización proximal al centrómero seguida de tres bandas brillantes positivas de localización central. Estos autores proponen la posibilidad de estándarización del bandeo R y su uso rutinario ya que presenta ciertas ventajas con respecto al bandeo G en relación a la distinción entre los cromosomas 4-6-9, 17-18, 22-23, y 24-25-27.
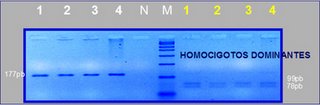
Di Berardino et al. (1985) presentan un patrón de bandeo RBA de alta resolución en cromosomas de Bos taurus, utilizando timidina o metotrexato para la sincronización de cultivos linfocitarios con incorporación tardía de BrdU. Con la sincronización celular obtuvieron un alto porcentaje de células en estados prometafásicos o en etapas metafásicas tempranas, apareciendo los cromosomas más elongados. Con esta técnica, se logra aumentar un 50% el número total de bandas observadas anteriormente. Mientras en el año 1982, Di Berardino y Iannuzzi detectaron un total de 351 bandas R (sumatoria de las bandas positivas y negativas), en 1985 utilizando técnicas de alta resolución se logra observar un total de 521 bandas. Cuando comparan con el estándar para bandeo G de 310 bandas, (Ford et al. 1980) el incremento se eleva un 70%. En el año 1989 se realiza la Segunda Conferencia Internacional para Estándarización de Cariotipos de Animales Domésticos, en la cual se estándarizan 410 bandas G (bandeo GTG) y 404 bandas R (bandeo RBA). El brazo q del cromosoma X queda dividido en cuatro regiones con 17 bandas G y 18 bandas R respectivamente. En cuanto al bandeo G se establece, una gran banda central negativa (3. 1); cuatro bandas positivas en la parte proximal del Xq (1. 2, 2. 2, 2. 4, 2. 6) y cuatro bandas positivas en la parte distal del Xq (3. 2, 3. 4, 3. 6, 4. 2), apareciendo el telómero como G negativo. Mediante el bandeo R, los autores establecen un grupo de tres bandas positivas (2. 5, 3. 1, 3. 3) en el centro del Xq, una larga banda negativa (2. 4) por encima del grupo anterior, y dos bandas negativas (3. 4, 3. 6) separadas por una pequeña banda positiva (3. 5), en la parte terminal, dos bandas positivas (4. 1, 4. 31) con un telómero negativo. En el año 2000 la Internacional System for Chromosome Nomenclatura of Domestic Bovids (ISCNDB) establece un idiograma estandarizado para el bovino con banda RBG y GTG. A nivel del cromosoma X este idiograma establece un total de 25 bandas RBG ( 12 R+ y 13 R-).
En Uruguay los primeros trabajos en citogenética de bovinos fueron realizados en 1956 por Postiglioni y Rossi utilizando como material, testículos de toro (Bos taurus). Dichos autores realizan un profundo estudio sobre la espermatogénesis de esta especie utilizando técnicas de aplastado y de inclusión, confirmando con los estudios cromosómicos de metafases goniales, el número cromosómico 2n=60. Posteriormente mediante la aplicación de técnicas de cultivo linfocitario, Vargas et al. (1987) realizan el estudio citogenético de un bovino seudohermafrodita masculino de la raza Holando Uruguayo que presentaba un cariotipo 60, XX/60, XY. Los primeros trabajos citogenéticos en hembras de bovinos Holando-Uruguayo comienzan a llevarse a cabo en el Laboratorio de Citogenética de Animales Domésticos de la Facultad de Veterinaria de Uruguay, en el año 1988 por Postiglioni y Llambí registrándose cariotipos obtenidos de cultivos linfocitarios.






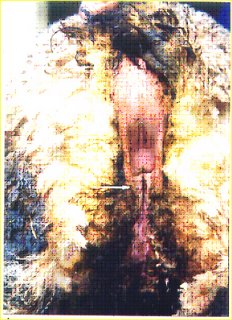 En la imagen se observa la parte posterior del animal donde la malformación de la uretra le da un aspecto de seudovulva entre la bolsa escrotal. La lana de la región se encuentra manchada de orina debido al mal cierre de la uretra (animal de aspecto intersexuado).
En la imagen se observa la parte posterior del animal donde la malformación de la uretra le da un aspecto de seudovulva entre la bolsa escrotal. La lana de la región se encuentra manchada de orina debido al mal cierre de la uretra (animal de aspecto intersexuado).